2023年6月28日,国家药监局(NMPA)官网公示,齐鲁制药新型ALK/ROS1抑制剂伊鲁阿克(曾用名:依鲁奥克,代号:WX-0593)已获批上市,用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
此前,2021年7月28日,药监局受理了伊鲁阿克用于治疗既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的ALK融合基因阳性的局部晚期或转移性NSCLC患者的上市申请。
伊鲁阿克是齐鲁制药有限公司自主研发的一种新型高选择性口服酪氨酸激酶抑制剂(TKI)。临床前研究数据显示,伊鲁阿克对不同融合类型及耐药突变的ALK和ROS1阳性的肿瘤细胞均具有显著的增殖抑制作用,在动物实验中也显示出优秀的抗肿瘤作用。

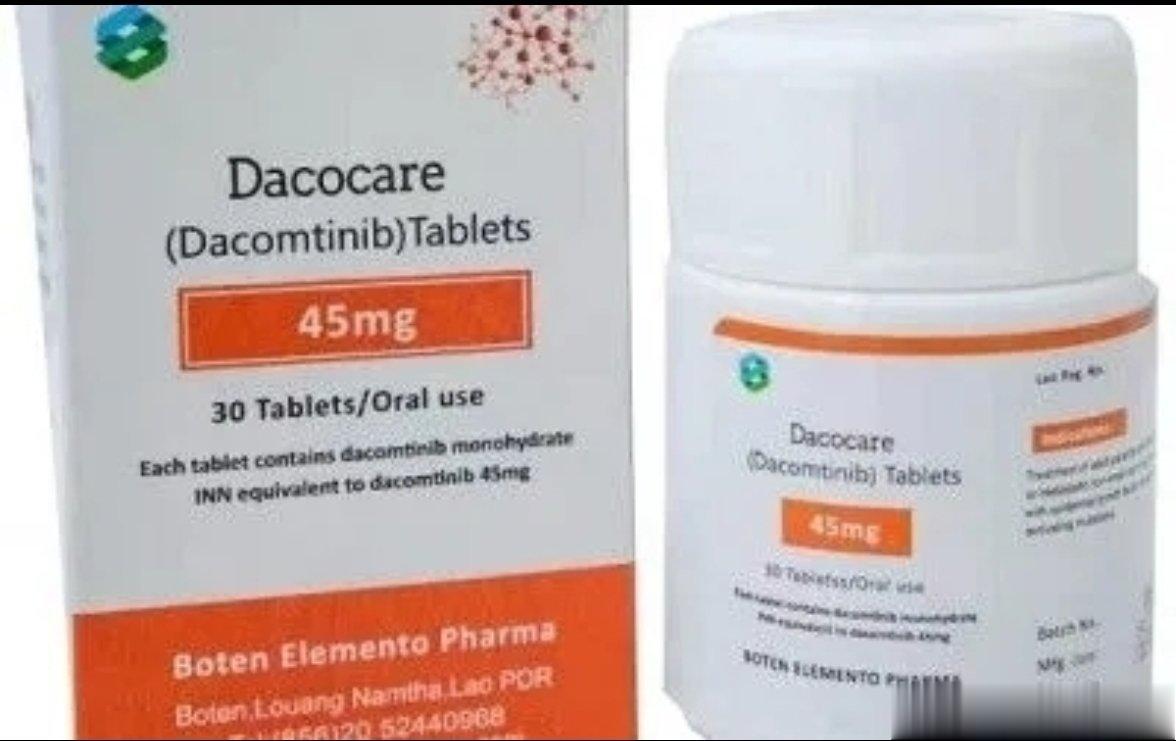
商品名:启欣可
通用名:伊鲁阿克/依鲁奥克(iruplinalkib)
代号:WX-0593
靶点:ALK/ROS1
厂家:齐鲁制药
美国首次获批:尚未获批
中国首次获批:2023年6年
获批适应症:ALK阳性的局部晚期或转移性非小细胞肺癌
临床数据
2022年6月,《临床肿瘤学杂志》公布了伊鲁阿克治疗晚期ALK/ROS1阳性NSCLC患者的II期试验结果。
在2019年8月7日至2020年10月30日期间,这项II期试验共纳入了146例患者。90例(61.6%)患者有脑转移,其中41例(46%)有可测量的颅内病变;20例(22%)接受了脑放疗,56例(38.4%)患者接受了化疗。患者接受口服伊鲁阿克180mg每日1次(引入期7天,60mg每日1次)。
试验的主要终点由独立审查委员会(IRC)根据RECIST v1.1确认的客观缓解率(ORR)。次要终点包括IRC确认的疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)、疾病进展时间(TTP)和安全性。
试验结果显示,由独立审查委员会(IRC)评估的ORR为67.8%,DCR为96.6%;由研究者评估的ORR为61.6%,DCR为94.5%,中位DOR为13.1个月,中位PFS/TTP均为14.4个月;18个月OS率为81.9%。

此外,亚组分析表明,经IRC评估的ORR在无脑转移的患者(79% VS 61%)或接受脑放疗的患者(66% VS 45%)中略高。既往接受化疗或未接受化疗的患者有类似的结果(71% VS 66%)。
在有可测量颅内病变的患者中,颅内ORR为63%,生存期(OS)数据不成熟。
安全性
在安全性方面,146例患者中134例(91.8%)发生了治疗相关不良反应(TRAEs)。最常见的不良反应包括:天冬氨酸转氨酶(AST)升高(41.1%)、丙氨酸转氨酶(ALT)升高(35.6%)、血肌酸磷酸激酶升高(33.6%)。
小结
该试验结果显示,对于克唑替尼耐药的ALK阳性NSCLC患者,伊鲁阿克具有良好的疗效和可控的安全性。此次伊鲁阿克的上市为ALK阳性的局部晚期或转移性NSCLC患者提供了新的治疗选择。
参考来源:
https://www.nmpa.gov.cn
https://www.qilu-pharma.com
【重要提示】所有文章信息仅供参考,具体治疗谨遵医嘱!